研究内容
研究内容
当部門では、心血管組織のダイナミズムを統合的に理解することを目指し、分子から細胞・組織にわたる多階層レベルで心循環恒常性維持の分子制御基盤を明らかにしようとしています。特に以下の2つに焦点を当てて研究しています。
1.硫黄循環・代謝を基軸とした生体レドックス恒常性の分子基盤の構築
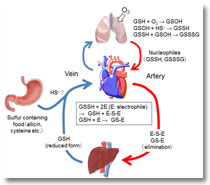
活性酸素(Reactive Oxygen Species: ROS)は古くから細胞毒として考えられてきましたが、その一方で様々な細胞応答を引き起こすシグナル仲介分子としても働くことが明らかにされ、いわゆる酸化還元(レドックス)の概念で創薬ストラテジーを立てることが難しくなってきています。私たちは、ROSと生体分子との反応で生じる2次生成物(親電子物質)が心不全などの慢性病態・疾患の誘導因子となること、およびポリ硫黄化物をはじめとする活性硫黄種が親電子物質を消去する求核置換基として心筋保護に働くことを新たに見出しました。最近では、心臓では活性硫黄が作られておらず、体肺循環を介して心臓に蓄積する機構が存在する可能性も見出しています(図1)。当部門では、心筋老化の誘導因子として新たに見出した親電子物質(8-nitro-cGMP)を疾患の実態を反映する内因性物質と捉え、親電子物質とその求核置換代産物の量的変化と病態との関連を示すことで、硫黄循環・代謝を基軸とした新奇な生体レドックス恒常性制御基盤を構築することを目指します。
2.内分泌誘導型Ca2+チャネルによる心循環恒常性制御
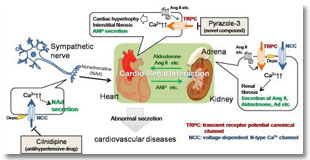
細胞内のカルシウムイオン(Ca2+)は、情報伝達を仲介する重要なシグナル伝達分子として働いています。私たちは、心臓の興奮転写連関を制御するCa2+チャネルの分子実体がTRPC3/6複合体チャネルであること、TRPC3/6複合体チャネルが血行力学的負荷によって生じる様々な末梢臓器からの内分泌を制御する機械活性化チャネルであることを見出しました。さらに、内分泌誘導型Ca2+チャネルを特異的に阻害する化合物が心血管保護作用を示すことも明らかにしてきました(図2)。しかし、これらCa2+チャネル群が普段何をしているのか、その生理的役割については未だによくわかっていません。当部門では、Ca2+チャネル遺伝子欠損マウスや初代培養細胞などを用いて、血行動態の「揺らぎ」によるTRPC3/6複合体チャネルシグナリングの時空間的制御機構を明らかにすることを目指します。
Figure 1. Putative mechanism of regulation of cardiac redox homeostasis by cardiocirculatory reactive sulfur species (RSS). RSS function as a nucleophile, directly eliminating endogenous electrophiles that are main causes of chronic cardiovascular diseases.
Figure 2. Control of cardiac homeostasis by the interaction among circulatory organs. A mechano-activated Ca2+-permeable channels (TRPC3/6) activated by hemodynamic load are found to mediate neurohumoral secretions required for circulatory cross-talks among multiple organs.
Select Reference
- Nishida M, Sawa T, Kitajima N, Ono K, Inoue H, Ihara H, Motohashi H, Yamamoto M, Suematsu M, Kurose H, van der Vliet A, Freeman BA, Shibata T, Uchida K, Kumagai Y and Akaike T. Hydrogen sulfide anion regulates redox signaling via electrophile sulfhydration. Nature Chem. Biol. 8: 714-724 (2012).
- Nishioka K, Nishida M, Ariyoshi M, Saiki S, Jian Z, Hirano M, Nakaya M, Sato Y, Kita S, Iwamoto T, Hirano K, Inoue R and Kurose H Protein kinase A-mediated phosphorylation of TRPC6 channels underlies suppression of angiotensin II-induced vasoconstriction. Arterioscler. Thromb. Vasc. Biol. 31: 2278-2286 (2011).
- Nishida M, Ogushi M, Suda R, Toyotaka M, Saiki S, Kitajima N, Nakaya M, Kim K-M, Ide T, Sato Y, Inoue K and Kurose H Heterologous down-regulation of angiotensin type1 receptors by purinergic P2Y2 receptor stimulation through S-nitrosylation of NF-kB. Proc. Natl. Acad. Sci. USA. 108: 6662-6627 (2011).
- Numaga T, Nishida M, Kiyonaka S, Kato K, Katano M, Mori E, Kurosaki T, Inoue R, Hikida M, Putney JW Jr, and Mori Y Ca2+ influx and protein scaffolding via TRPC3 sustain PKCβ and ERK activation in B cells. J. Cell Sci. 123: 927-938 (2010).
- Nishida M, Sato Y, Uemura A, Narita Y, Tozaki-Saitoh H, Nakaya M, Ide T, Suzuki K, Inoue K, Nagao T & Kurose H P2Y6 Receptor-Ga12/13 Signaling in Cardiomyocytes Triggers Pressure Overload-induced Cardiac Fibrosis. EMBO J. 27: 3104-3115 (2008).